7月8日,国家药品监督管理局发布《国家药监局关于进一步明确射频治疗仪类产品有关要求的公告(2024年第84号)》,明确自2026年4月1日起,《关于调整〈医疗器械分类目录〉部分内容的公告》(2022年第30号)附件中09-07-02射频治疗(非消融)设备中射频治疗仪、射频皮肤治疗仪类产品,未依法取得医疗器械注册证的,不得生产、进口和销售。

监管政策逐步松绑 射频美容仪迎两年“宽限期”
回顾射频美容仪相关法规的出台历史,可以看出,射频美容仪行业的监管政策经历了“从严到宽”的转变。
2021年4月国家药监局发布的《关于征求(征求意见稿)意见的通知》中,指出三类射频美容仪纳入医疗器械管理,透露出射频美容仪将被纳入医疗器械管理的趋势;2022年3月《关于调整部分内容的公告》,明确到2024年4月1日起,射频类美容仪将纳入三类医疗器械进行管理,未依法取得医疗器械注册证不得生产、进口和销售。
再到今年3月27日,中国食品药品检定研究院器械标管中心发布的一则《射频治疗仪、射频皮肤治疗仪类产品分类界定解读》公告,对涉及美容用途射频类产品的管理属性和管理类别进行进一步划分和解读,指出仅用于“精华的皮肤无创促渗(不用于药品和医疗器械促渗)、促进精华吸收、皮肤表面清洁、温热按摩、物理按摩、肌肤放松、去除角质”或类似用途的射频类产品,则不符合医疗器械定义,不作为医疗器械管理。
此次,第84号公告的发布,无疑是对射频治疗仪类产品在监管层面的再次“松绑”,延长两年过渡期,不仅给足了相关企业足够的缓冲时间来推进完善产品注册手续,同时也减少了政策调整对市场带来的冲击,为行业的平稳过渡提供了有力支持。
新规的延期实施无疑为整个行业带来重大转折和发展机遇。家用美容仪品牌AMIRO觅光相关负责人表示,政策的松绑给品牌足够的缓冲时间去适应新政策、完成注册手续,同时也有利于市场上已有的合规产品能够继续流通,避免了资源浪费,保障消费者的需求,也让品牌能更专注于技术研发和产品创新,有更多时间去提升产品技术、完善质量管理体系,推动行业健康可持续发展。
大浪淘沙 AMIRO觅光等品牌“勇立潮头”
据了解,第三类医疗器械是我国最高级别的医疗器械,通常指的是具有较高风险、需要进行严格控制以保证其安全性和有效性的医疗器械,管控尤为严格。
AMIRO觅光相关负责人表示,三类医疗器械注册流程复杂,产品检验、临床试验等产品注册程序需要投入大量时间和成本,对企业的专业性、研发能力、资金实力以及对相关监管政策的理解程度等方面都提出了很高的要求。
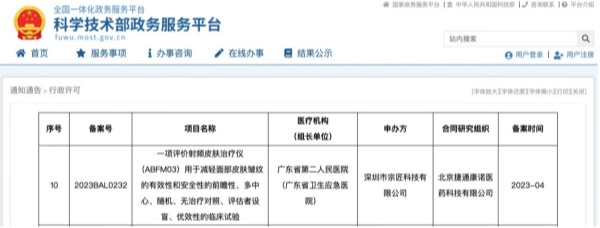
严苛的取证流程给射频美容仪玩家设立了一道极高的门槛,但仍有少数有实力的品牌挤进了“决赛圈”,根据国家科学技术部政府服务平台信息显示,2022年3月至今,已有觅光等4家美容仪头部品牌关联公司申报了评估“射频皮肤治疗仪安全性和有效性”的临床试验。
此前,觅光也在其品牌公开声明中表示,公司是国内第一批布局家用射频美容仪三类医疗器械注册的企业,已经领先于同行完成了产品的临床和检验,并正式提交国家药品监督管理局进行注册,取证有序推进。
据公开资料显示,觅光早已率先做好了行业医疗转型的准备,自2020年便开始了全面医疗化布局,于2022年拿到了二类家用强脉冲光治疗仪注册证,先后与国内多家三甲医院展开临床合作,展开多中心的、多人群、多场景的人体功效临床试验,以循证医学验证产品的有效性和安全性。
无疑,射频美容仪新规的落地不仅是对产品本身的一次洗礼,更是对整个行业生态的一次重塑,强监管可以保障射频类美容产品的安全性、有效性,也会降低行业虚假宣传、产品缺陷等问题的概率,消费者对家用美容仪的信任度会大大提高,整个行业也将更聚焦于技术研发、产品创新的良性竞争,促使企业从短期利益转向长期可持续发展,也将推动整个行业向更规范、更稳健、更高质量的方向发展。
















